第3回(2020.12.24)コロナ禍における心不全患者の予防と治療・管理,
終末期の緩和ケア
北海道大学循環病態内科学教室
安斉俊久
新型コロナウイルス感染症(COVID-19)によるパンデミックは,世界の風景を一変させ,多くの人命が現在も失われつつあるが,その多くは心血管疾患の既往を有する症例であり,なかでも心不全患者は重篤な病態に陥る危険が高いとされている1-3)。それは,心不全患者の多くが高齢者であるためだけでなく,COVID-19による心筋障害あるいはサイトカインストームともいわれる全身性炎症反応を介して心不全の病態を悪化させるためと考えられている4)。中国,武漢からの初期の報告では,COVID-19患者のうち23%が心不全を併発し,死に至った症例では心不全の合併率が52%と生存例の12%に比べ有意に高かった5)(表1)。COVID-19が発生する以前より,心不全患者はパンデミックのごとく増加しているといわれてきたが,COVID-19による真のパンデミックが発生したことで,両者が相乗的に作用することにより,多くの生命が危険にさらされている。本稿では,心不全とCOVID-19の関係性,心不全患者におけるCOVID-19の予防,そして合併時の対応などを中心に述べることとする。
| 合併症 | 全例 (191例) |
死亡 (54例) |
生存 (137例) |
P値 |
|---|---|---|---|---|
| 敗血症 | 59% | 100% | 42% | P <0.0001 |
| 呼吸器疾患 | 54% | 98% | 36% | |
| 急性呼吸窮迫症候群 (ARDS) |
31% | 93% | 7% | |
| 心不全 | 23% | 52% | 12% | |
| 敗血症性ショック | 20% | 70% | 0% | |
| 凝固異常 | 19% | 50% | 7% | |
| 急性心障害 | 17% | 59% | 1% | |
| 急性腎障害 | 14% | 50% | 1% | |
| 二次感染 | 15% | 50% | 1% | |
| 低蛋白血症 | 12% | 37% | 1% | |
| アシドーシス | 9% | 30% | 1% |
心不全とCOVID-19における共通の病態と相互作用
・HFrEF
心不全の病態においては,神経体液性因子の賦活化に加え,酸化ストレスの増大とともに全身性の炎症反応が惹起されている6)。左室駆出率(LVEF)の低下した心不全(HFrEF)においては,神経体液性因子の抑制薬であるアンジオテンシン変換酵素(ACE)阻害薬やアンジオテンシンⅡ受容体拮抗薬(ARB),ミネラルコルチコイド受容体拮抗薬(MRA),そしてβ遮断薬がLVEFの改善とともに生命予後を改善することが報告されてきた。しかしながら,炎症や酸化ストレスを標的とした治療法はいまだに見出されていない。
・HFpEF
LVEFの保たれた心不全(HFpEF)では,加齢や肥満,糖尿病,高血圧,慢性腎臓病,慢性閉塞性肺疾患などにより,全身性の炎症反応,酸化ストレスが惹起されることで,心筋の肥大・線維化が生じ,拡張機能障害を主体とした心不全を呈すると考えられている7)。HFpEF患者に対して神経体液性因子抑制薬を用いたランダム化比較試験では,いずれも有意な結果が得られておらず,高齢化や併存症の有病率増加により,患者数は世界的に増加している。
HFpEFにみられるような炎症を背景とした病態では,COVID-19によるサイトカインストームによって急激に悪化する可能性が考えられている。実際に高齢者や併存症を有する症例では,COVID-19発症後の予後がきわめて不良であるといわれている。
・COVID-19は心不全の直接の原因となる
COVID-19は心筋炎の合併のみならず,炎症の惹起や血栓症の発生を介して心血管系にさまざまな障害をもたらすことが明らかにされている。入院となったCOVID-19患者では,75%に心電図異常,20%に血中トロポニンの上昇を認め,経胸壁心エコーや心臓MRIにおいて,心筋の肥厚・浮腫,左室収縮能の低下をしばしば認めることが報告されている8)。また,脳性ナトリウム利尿ペプチド(BNP)あるいはN末端プロ脳性ナトリウム利尿ペプチド(NT-proBNP)の上昇を認めるCOVID-19症例では,予後が不良であることも明らかにされており,COVID-19そのものが心不全の原因となる。
・COVID-19による血栓塞栓症
COVID-19は,血管内皮機能障害・炎症とともに凝固カスケードを活性化させることにより,血栓塞栓症を引き起こすことも明らかにされている8)。心不全患者は,もともと血栓塞栓症のリスクは高いが,COVID-19では深部静脈血栓に伴う肺血栓塞栓症が高率に発生し,心不全悪化の原因となる。これらを早期に発見するうえでDダイマーの測定は有用とされている8)。
このように,心不全とCOVID-19は,炎症や血管内皮機能障害,凝固カスケード亢進といった共通の病態を背景として,相互に病態を悪化させ,悪循環を形成していると考えられる。
心不全患者におけるCOVID-19の予防
・遠隔治療の重要性
心不全患者におけるCOVID-19の合併は致死的となるリスクが高く,感染予防がもっとも重要である。発熱患者が多く集まる医療機関への受診は,感染リスクを高める可能性がある。最近では,日本でも電話診療が保険償還されるようになったが,植込み型除細動器(ICD)や心臓再同期療法(CRT)を用いた遠隔モニタリングシステムの利用や患者自身によるバイタル,体重測定などのセルフケアがより重要となる。処方に関しても,パンデミックがより深刻な海外では,内服薬の郵送などが行われているのが現状である8)。
・心不全患者の家族に対するスクリーニング
家族や介護者の感染予防も重要となる。体温や症状チェックだけではCOVID-19のスクリーニングとしては不十分であり,今後は患者本人のみならず介護者に対しても,より積極的なPCR検査が必要であると考えられる。さらに,心不全とCOVID-19は,呼吸困難や息切れ,倦怠感など,類似した症状を呈するため,その鑑別はしばしば困難である。スクリーニング検査として,現在のPCR検査よりも迅速かつ正確な診断キットの開発が望まれる。
・心臓リハビリテーション,在宅療法患者のケアの注意点
心臓リハビリテーションは,心不全患者の予後を改善するうえで重要な非薬物療法であり,流行地域や院内感染が発生した施設以外においては,クラスター発生を防ぐための十分な措置を行いながら適切な導入・継続が望ましい。具体的には,患者の体調確認や体温の測定以外に,同一フロアに密集しないように時間帯を分ける,リハビリテーション機器の間隔を2 m以上空ける,使用機器の消毒,患者・医療従事者のサージカルマスク装着,手指消毒,高強度運動の回避,開窓や空調による換気,患者間の2 m以上の距離の確保,会話時における真正面からの対面回避,などが重要となる。
また,在宅療養患者において心臓リハビリテーション施行可能な場合には,運動処方箋を作成のうえ,自宅での運動療法について指導を行うことも考慮すべきである9)。
心不全患者におけるCOVID-19合併時の対応
・早期の確定診断の重要性
心不全患者においては,COVID-19の合併が致命的ともなり得るため,できるだけ早期の確定診断が重要となる。しかしながら,心不全によるうっ血と肺炎の鑑別はしばしば困難であり,発熱などの症状は診断する上での感度が低いことから,疑われる症例に対しては,血清C反応性蛋白(CRP)の上昇,末梢血リンパ球の減少がないかを確認するとともに,血液酸素飽和度の測定,胸部CTスキャンなどよる多面的なスクリーニングが必要となる8)。今後,日本において感染拡大がさらに進めば,入院時のルーチン検査の中に唾液を用いたPCR検査が組み込まれていくものと思われる。
・COVID-19の確定診断後の管理
COVID-19と確定診断された場合には,心不全の増悪がないか確認するとともに心エコーにより下大静脈径を測定するなど,体液量をアセスメントすることが必須である。COVID-19においては,全身性炎症反応にともない脱水傾向に陥り易く,血管透過性亢進によって間質への体液移行を認める場合もあるため,利尿薬内服患者では,その用量調整を慎重に行う必要がある8)。
・ACE阻害薬・ARBの継続を推奨
新型コロナウイルスはACE2を介して細胞内に侵入することが知られている10)。ACE2はアンジオテンシンⅡを分解し,Ang(1-7)を産生する酵素であるが,ACE阻害薬あるいはARBは,ACE2の発現を上昇させるため,感染リスクを上昇させ,COVID-19を悪化させるのではないかと当初は懸念された。しかしながら,最近の多くの研究によって,これらの薬剤が感染リスクを上昇させず11),アンジオテンシンⅡを介した炎症反応を抑制することにより,COVID-19に対してむしろ保護的に働く可能性があること,心血管疾患を有するCOVID-19患者の死亡率を増加させないことが報告された8)。これらの研究結果に基づき,心不全患者に対しては心不全の悪化を防ぐ意味でもACE阻害薬,ARBの継続が推奨されている8)。
・人工呼吸器,体外式膜型人工肺(ECMO)
心不全合併例では,重症化により人工呼吸器や体外式膜型人工肺(ECMO)を用いる可能性も高くなる。ECMOの場合,通常は静脈から脱血し静脈に送血を行うVV-ECMOが使用されるが,呼吸不全に加えて心原性ショックを合併した場合には,循環補助のために動脈に送血するVA-ECMOが使用される。これらはCOVID-19から回復するまでのあいだ,生命を維持する上で非常に有効な治療法である。しかし一方で,ECMOによるリンパ球減少が,ウイルスに対する免疫応答を抑制し,炎症をさらに活性化させてしまう可能性が懸念されている12)。医療資源の有限性を考慮すると,これらの治療を選択する場合には,より有効かつ安全に使用可能な症例をいかにして見出すかが今後の課題である。
緩和ケアの視点から
より多くの患者を救い,また回復後の長期生存を目指すうえでは,有限である医療資源の活用において一定のシステムが必要と考えられている13)。パンデミック初期段階では,人工呼吸器の不足から,使用する症例の選択が医療現場に委ねられ,患者や家族,医療者に対して大きなストレスを与えたことは記憶に新しい。COVID-19のパンデミック収束には,さらに多くの時間を要する可能性が高く,人工呼吸器やECMOの増産,集中治療室の整備などの対応はなされているものの,これらの治療に対する有効性・安全性を判断する客観的なシステムの構築が医療現場のストレスを回避するうえで重要である(図1)14)。
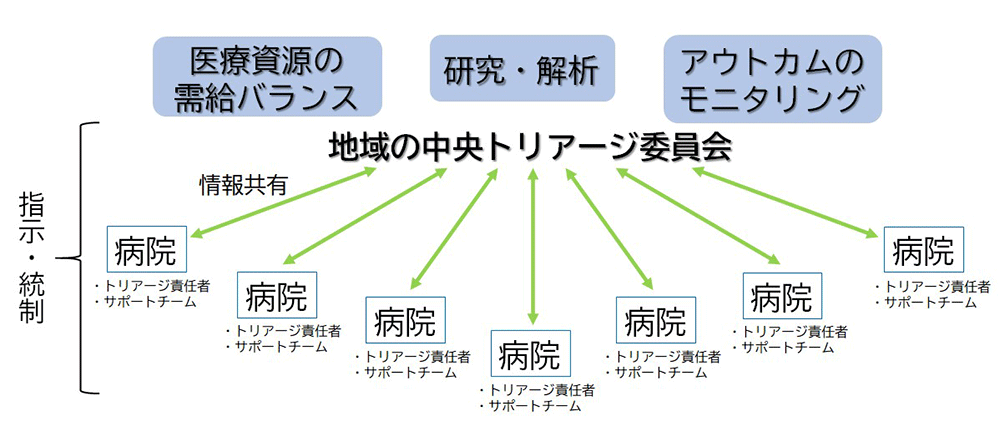
病床数,医療スタッフ数,人工呼吸器やECMOなどの医療資源の需給バランス,感染の拡大状況などの情報を,地域における中央トリアージ委員会で収集し,各医療機関と情報を共有するとともに,データ解析結果に基づいた選択すべき治療方針を各医療機関に指示する。その後のアウトカムを中央でモニタリングしながら各医療機関にフィードバックを行う。
心不全では,終末期に至る前の段階において,本人が人生の最終段階において希望する医療やケアについて,患者・家族・医療者が話し合うプロセスであるアドバンス・ケア・プランニング(ACP)がガイドラインでも推奨されている15)。心不全患者にとって,COVID-19は何としても回避しなければならないものであるが,今後はCOVID-19合併時における治療に関しても,ACPに含まれる時代になると考えられる。
文献
- 1) Wang D, Hu B, Hu C, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA 2020; 323: 1061-1069.[PubMed]
- 2) Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395: 497-506.[PubMed]
- 3) Guan WJ, Zheng YN, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020; 382: 1708-1720.[PubMed]
- 4) Guan WJ, Zheng YN, Hu Y, et al. Potential Effects of Coronaviruses on the Cardiovascular System: A Review. JAMA Cardiol 2020; 5: 831-840.[PubMed]
- 5) Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395: 1054-1062.[PubMed]
- 6) Anzai T. Inflammatory Mechanisms of Cardiovascular Remodeling. Circ J 2018; 82: 629-635.
- 7) Shah SJ, Kitzman DW, Borlaug BA, et al. Phenotype-Specific Treatment of Heart Failure With Preserved Ejection Fraction: A Multiorgan Roadmap. Circulation 2016; 134: 73-90.
- 8) Zhang Y, Coats AJS, Zheng Z, et al. Management of heart failure patients with COVID-19: a joint position paper of the Chinese Heart Failure Association & National Heart Failure Committee and the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2020; 22: 941-956.[PubMed]
- 9) 日本心臓リハビリテーション学会.COVID-19に対する心臓リハビリテーション指針第2報.
http://www.jacr.jp/web/wp-content/uploads/2020/07/jacr_covid19_2.pdf[2020年12月11日閲覧] - 10) Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020; 579: 270-273.[PubMed]
- 11) Reynolds HR, Adhikari S, Pulgarin C, et al. Renin-Angiotensin-Aldosterone System Inhibitors and Risk of Covid-19. N Engl J Med 2020; 382: 2441-2448.[PubMed]
- 12) Henry BM. COVID-19, ECMO, and lymphopenia: a word of caution. Lancet Respir Med 2020; 8: e24.[PubMed]
- 13) Emanuel EJ, Persad G, Upshur R, et al. Fair Allocation of Scarce Medical Resources in the Time of Covid-19. N Engl J Med 2020; 382: 2049-2055.[PubMed]
- 14) Maves RC, Downar J, Dichter JR, et al. Triage of Scarce Critical Care Resources in COVID-19 An Implementation Guide for Regional Allocation: An Expert Panel Report of the Task Force for Mass Critical Care and the American College of Chest Physicians. Chest 2020; 158: 212-225.[PubMed]
- 15) Tsutsui H, Isobe M, Ito H, et al. JCS 2017/JHFS 2017 Guideline on Diagnosis and Treatment of Acute and Chronic Heart Failure- Digest Version. Circ J 2019; 83: 2084-2184.[PubMed]