第5回(2021.2.4)COVID-19における“ファクターY”
~なぜ若齢では重症化しないのか~
慶應義塾大学医学部微生物学免疫学教室
吉村昭彦
2019年末に中国武漢で発生した新型コロナウイルス(SARS-CoV-2)は,全世界に拡散しパンデミックとなった。このような状況下で,COVID-19の感染拡大と重症化における地域差と年齢差が注目されている。
最初の流行は中国武漢で発生したものの,中国政府の封じ込め政策が奏功したのか,中国全体の感染者・死者数ともに欧米よりも格段に少ない。また日本ではPCR検査数が先進国のなかでも最低レベルであり,2020年春の緊急事態宣言時には医療崩壊が懸念されていたが,死亡者数は1000人程度と極端に少なかった。
この頃,iPS細胞の研究でノーベル賞を受賞した山中伸弥教授は,日本でSARS-CoV-2の感染者数が少なく抑えられている原因を「ファクターX」とよび,欧米でも「日本の謎」としてとりあげられた。しかし,全世界で人口10万人あたりの死亡者数を見ると,中国・日本だけでなく多くの東南アジア諸国が欧米の100分の1程度であり,「ファクターX」は何らかの地域差を反映する科学的な事象ではないかと考えられた。
しかし,残念ながら現在の日本の感染爆発に近い状況では欧州のレベルに近づいており,「“ファクターX”は幻想」ともいわれている。
一方で,成人に比べ小児での感染者は少なく,重症化しにくいことは世界的な事実である。もちろん英国などからSARS-CoV-2に感染・重症化した小児の報告があり,すべての小児が感染に抵抗性を示すわけではないが,アジア・欧米を問わず小児の重症化例はきわめて少ない。同じ家族内の感染を調べた最近の研究では1),小児についても感染しないわけではなく,抗体も産生されている。しかし,その量は少なく,感染初期にウイルスが排除されている可能性が示唆された。この「小児が成人に比べて感染に強い」原因を,私は「ファクターY」とよんでいる。
この地域差や年齢差の要因はまだ解明されていないが,多くの仮説が提唱されている。BCG仮説を含めた「自然免疫強化」説,「ACE2の発現量の違い」説,「免疫未発達」説のほか,有力な仮説と考えられているのが「交差免疫」説である。
「ファクターY」は交差免疫か?
・交差免疫とは
「交差免疫」とは,過去に「ある病原体」に感染したことで,その病原体に似ている別の病原体に対しても働く「免疫」のことである。これはSARS-CoV-2に限った現象ではない。古くは,18世紀にジェンナーによって行われた「種痘」の実験がある。当時すでに牛痘にかかったことがある者は天然痘に罹らないことが経験的に知られていた。そのような背景から,ジェンナーは牛痘ウイルスをヒトに感染させた後に,天然痘ウイルスを感染させると,天然痘を発症しないことを実験し,確認した。これは,牛痘ウイルスに対する免疫が,ヒトの天然痘ウイルスに対して交差反応することを利用したものである。
また,交差免疫はかならずしも病原体に対するものばかりではない。たとえばリウマチ熱という疾患は,A群連鎖球菌の菌体成分の蛋白質に対する抗体が,たまたまアミノ酸配列が似ている自己の心臓や関節の分子に対して交差反応を示すことにより,免疫系が自己の分子を攻撃することで引き起こされる。
・SARS-CoV-2に対する交差免疫
コロナウイルスの交差免疫とは,「ほかのコロナウイルス(亜種コロナウイルス)」に過去に感染したことで,新型コロナウイルス(SARS-CoV-2)に対しても働く「免疫」をいう。旧型ともいえる風邪コロナウイルス(human coronavirus: HCoV)は,HCoV-229E,HCoV-OC43,HCoV-NL63,HCoV-HKU1の4種類である。日常的にヒトに感染し,風邪の10~15%(流行期35%)は,この4種類のコロナウイルスが原因となる。冬季に流行のピークがみられ,多くの人が6歳前後までに感染を経験するが,多くは軽症である2)。
・小児・若者は風邪コロナウイルスの抗体を持つ
イギリスからの報告では,SARS-CoV-2非感染者のほとんどがいずれかの風邪コロナウイルスに対する抗体を保持していた3)。論文によると,非感染者の6%ほどから,SARS-CoV-2の蛋白質,とくにスパイク(S)蛋白質のS2部分に交差反応を示す抗体が検出された。またその抗体を試験管内でSARS-CoV-2にさらしたところ,特異的な中和作用を示した。
年齢別でみると,6~16歳では60%以上で抗体が検出された。一方,17歳以上では10%未満しか検出されなかった。この結果から,小児や若者が重症化しにくいのは,すでに持っている風邪コロナウイルスに対する抗体が関与していることが示唆された。
また,風邪コロナウイルスに感染した経験のある人は,ない人よりもCOVID-19による重症化の割合が著しく低かった4)。しかし,抗体価は長く持たず,多くは1~2年で減少し何度も感染を繰り返すようである5)。つまり,小児や若者は頻繁に風邪をひくため抗体価が高く,一方,高齢者はそれほど風邪をひかないため交差免疫が十分に働かない可能性が示唆された。
交差免疫に重要な獲得免疫系
・獲得免疫系(T細胞とB細胞)
交差免疫で働く免疫系は抗体を産出するB細胞とT細胞免疫の獲得免疫系である。そのなかでも「過去に感染を経験した」ことを記憶している記憶B細胞,記憶T細胞が関与している(図1)。
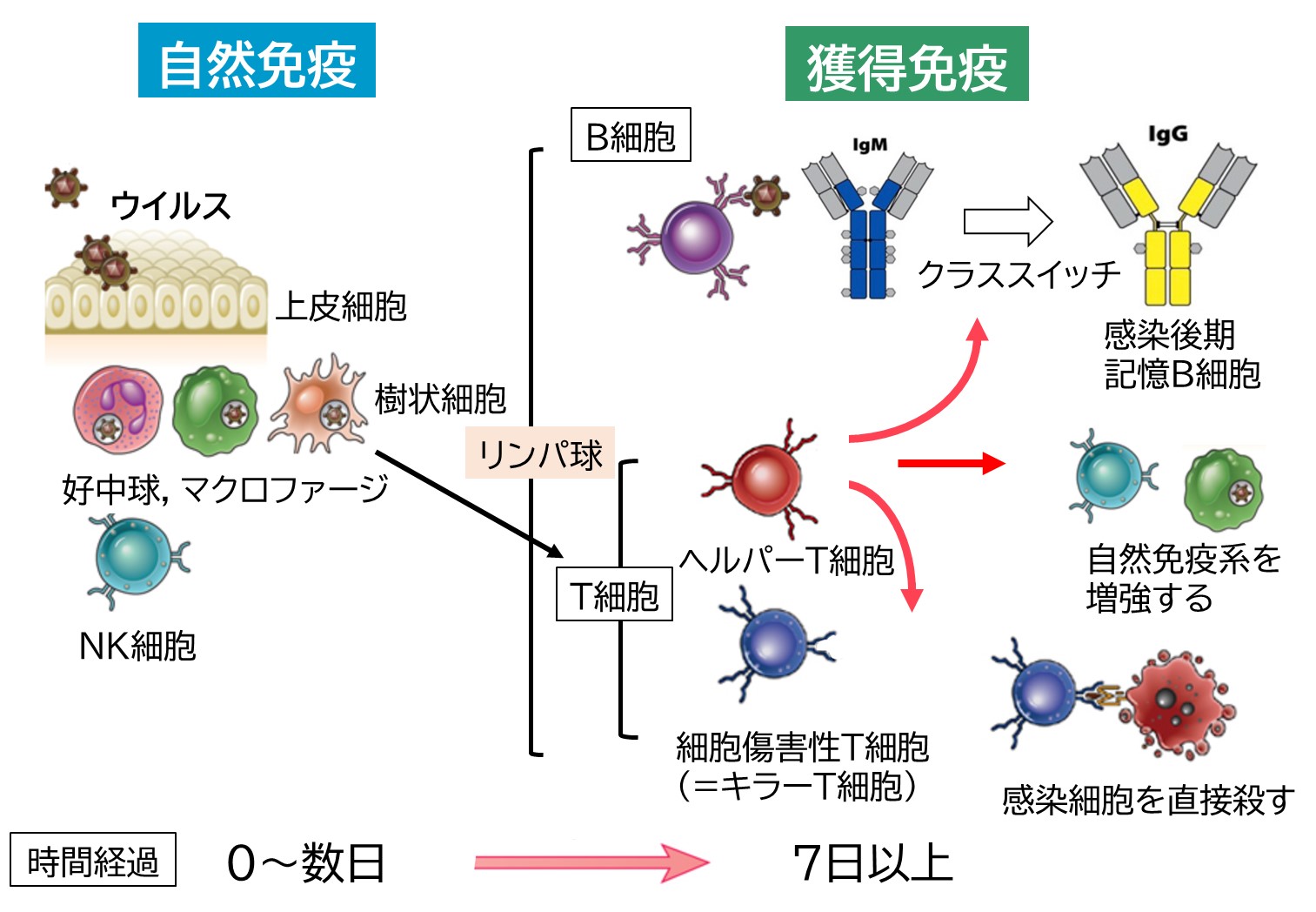
感染の極早期には,好中球,マクロファージ,NK細胞によりウイルスや感染細胞は処理される(自然免疫)。しかし,それを超えて感染が広がると獲得免疫が発動する。感染で死んだ細胞は樹状細胞に貪食され,樹状細胞は感染細胞内のウイルス抗原を抱えてリンパ節に遊走し,そこでウイルスに反応するT細胞クローンを活性化し増幅させる。T細胞には感染細胞を直接殺すキラーT細胞(細胞障害性T細胞,CTL)と,B細胞の抗体産生を助け,自然免疫系を増強するヘルパーT細胞が存在する。キラーT細胞は感染細胞の表面に提示されたclass-I HLA-抗原複合体という分子を認識して感染細胞を殺す。
・感染初期はIgM,感染後期はIgGが検出
T細胞クローンが増えるのに時間がかかるため,獲得免疫が有効になるのに1週間はかかる。一方で,B細胞は抗原を細胞表面の抗原受容体(抗体の初期段階の分子)で認識し,クローンが増えて,やがて抗体を細胞外に放出することになる。ここでヘルパーT細胞の助けを借りてより強力な抗体が作られる。IgMは感染初期に作られる抗体で,IgGはヘルパーT細胞の助けを借りてより強力になった抗体である(クラススイッチ)(図1)。
そのため,一般的には,ウイルス特異的なIgM抗体が検出されIgG抗体が検出されなければ感染初期と判断され,IgGも検出されるようになると感染後かなり時間が経過していると判断される。
・獲得免疫系は2度目の感染では素早く反応する
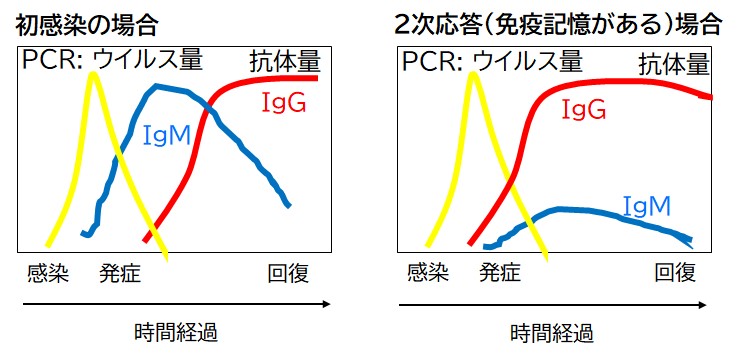
さて,免疫系がウイルスに勝ち,めでたく退院となる頃には,ごく一部の記憶T細胞や記憶B細胞(免疫記憶)を残して獲得免疫は戦線を縮小する。記憶B細胞は抗体を作り続けており,身体を巡っている抗体が次に侵入してきたウイルスを早期に排除する。キラーT細胞もいち早く感染を検知して感染細胞を殺す。よって免疫記憶が成立すると2度目以降のウイルス感染から身を守ってくれる。これがいわゆる「2度なし現象」で,ワクチンはこの現象を利用している。誤解されやすいのだが,免疫があれば決して感染しないわけではなく,実際には感染する。感染はするが早期にウイルスが排除されるので感染したことに気がつかないか,軽症ですむ。記憶T細胞や記憶B細胞は,2度目以降の感染では素早く増殖するので初感染のときよりも早く効果的に対応でき,これを2次免疫応答という。とくにヘルパーT細胞の記憶があれば,抗体価が落ちても2次応答の際はすぐにIgGが増える(図2)。
交差免疫に関する報告(日本)
初感染の場合は,まずIgMが立ち上がり,その後にIgGへとクラススイッチが起きるはずである。実際,2020年初頭の武漢での感染では,そのように報告された6)。ところが東京大学医学部附属病院検査部,蔵野博士らの報告では7),日本人のCOVID-19患者の血清中のIgMは,症状出現後9日目程度で上昇し,15~20日あたりを最大値として低下する傾向があった。一方,IgGは,症状出現後7日目くらいから上昇し,15日目以降では,全例で陽性となり,経過3週間ではその抗体価の低下は見られなかった(図2)7)。これは記憶B細胞や記憶ヘルパーT細胞の存在を示唆するものであり,新型コロナウイルスに感染したことがなければ,風邪コロナウイルスへの交差免疫を示唆するものである。なお,日本人の感染者では,約75%が交差免疫の存在を示唆する抗体量の変化のパターンを示した。
海外でも,COVID-19では,ほかのウイルス感染症と比べて,比較的早期にIgGが出現することが示されている8)。ただ測定系が異なる場合,風邪コロナウイルスに対する抗体の評価がされていない場合があるため,日本は他国と比べて,新型コロナウイルスに対する交差免疫が高頻度に存在しているとはいえない。
T細胞の交差免疫
・米国からの報告
交差免疫の抗体は早期に失われる可能性があるが,ヘルパーT細胞の記憶があれば2次応答の際はすぐにIgGが増えることが予想される。T細胞の交差免疫に関する最初の報告は,2020年6月にCellに発表された米国の研究グループによるものである9)。このグループは,SARS-CoV-2の感染拡大前に保存されていたSARS-CoV-2に感染歴のない人たちの血液細胞を調べたところ,キラーT細胞のうち約4割,ヘルパーT細胞のうち約6割に,SARS-CoV-2に反応するT細胞が見つかった。
・T細胞応答の実験室での調べ方
T細胞応答を調べるのには抗体よりも若干手間暇がかかる。T細胞の抗原受容体(TCR)はHLA分子に提示された9~10数個のアミノ酸からなる抗原ペプチドを認識する。HLAは人によって異なり,提示できるウイルスのペプチドは人によって異なるため,予想されるペプチドのプールを末梢血単核球に加えて24時間ほど培養してフローサイトメーターでT細胞の活性化状態を調べるか(図3A),Enzyme linked immuno spot(ELISPOT)アッセイ*により,活性化したT細胞を染色してカウントする方法がとられる(図3B,C)。
*活性化したT細胞はIFNγなどのサイトカインを産生する。IFNγ抗体を付着させたメンブレンシート上でT細胞を培養すると,T細胞からIFNγが分泌され,直ちにシートの上に捕捉される。そこに検出用のIFNγ抗体を反応させることで,T細胞の周辺部のみが小さなスポットとなる。
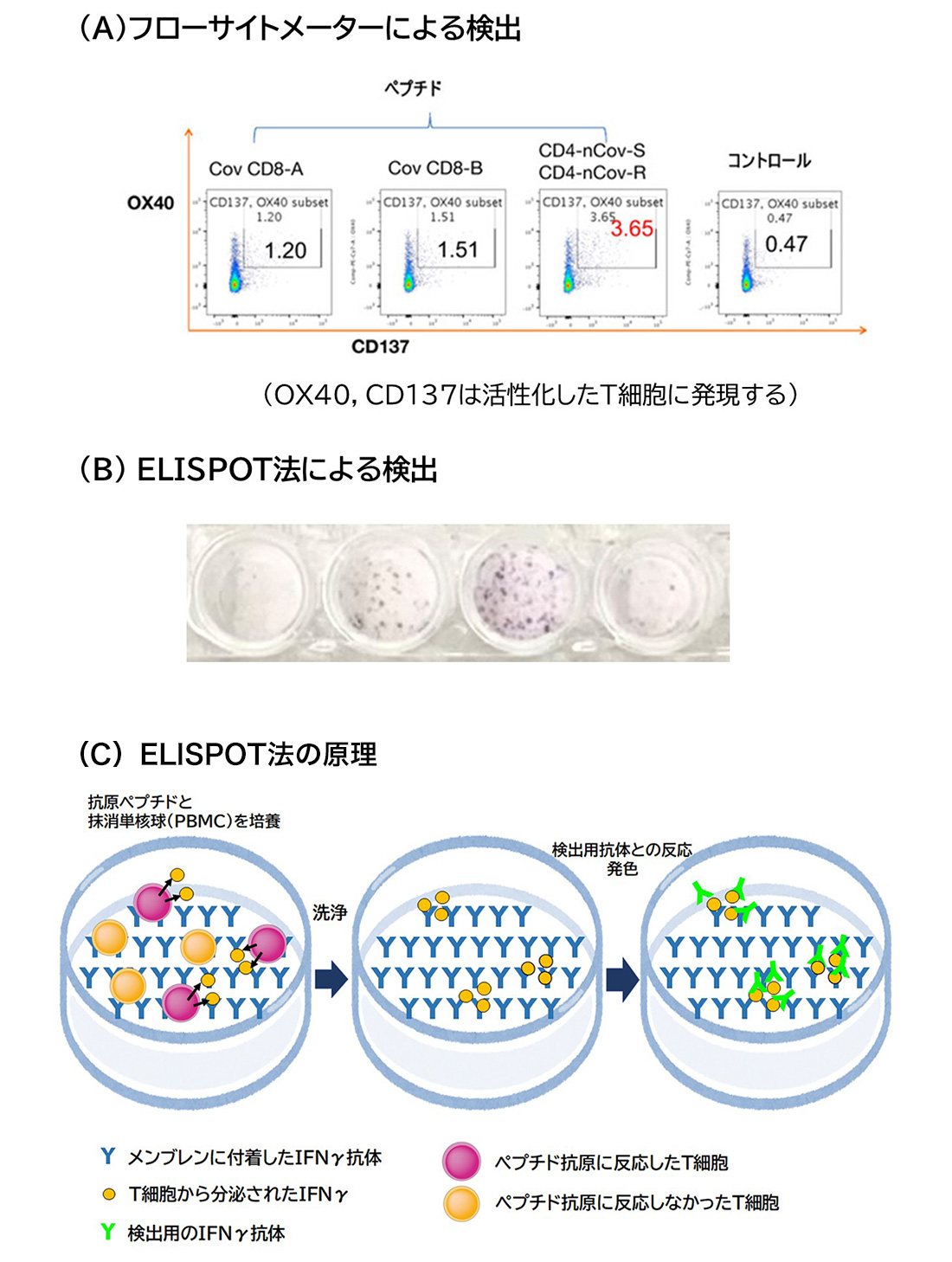
末梢血単核球約5×105個を抗原ペプチドと一晩培養し,(A)フローサイトメーターまたは(B)ELISPOTアッセイ(今回はIFNγで染色した)によりT細胞の活性化の程度を検出した。(未発表データ)
・T細胞によるコロナウイルスの認識
では,SARS-CoV-2に感染していない健康な人のT細胞は風邪コロナウイルスを認識しているのか。それを調べたのが米国の同じグループから報告された論文である10)。彼らは非感染者の血液からSARS-CoV-2抗原に反応するT細胞を分離し,大量に増殖させてクローンを作成したところ,このクローンは風邪コロナウイルスの抗原にも反応することを示した。この結果から,T細胞では交差反応が起こることが証明された。同様に交差反応を証明したドイツのグループは,ウイルス表面のスパイク(S)蛋白質のS1とS2のサブユニットのうち,S2に応答するT細胞が多いことを示した11)。SARS-CoV-2と風邪コロナウイルスのS蛋白質は,S1よりもS2のほうがアミノ酸配列がよく似ているためだと考えられる。またS蛋白質以外のコロナウイルス蛋白質でも交差反応を示すことが報告されている。
SARS-CoV-2と風邪コロナウイルスは基本的な構造は同じであり,共通に保存されている部分もあるが,アミノ酸配列は異なっていることが多い。T細胞のTCRはウイルスの9~10数個の抗原となるペプチドのうち,飛び飛びに存在する3〜4個ほどを認識しており,全体の6〜7割が一致すれば同じ蛋白質だと認識してしまう可能性がある。したがって,キラーT細胞で40%,ヘルパーT細胞で60%の交差反応がみられると考えられる9, 10, 11)。
交差免疫は軽症・無症状が多い理由となるのか
・シンガポールからの報告
小児や若者,あるいはある特定の地域で軽症者や無症状が多いのは交差免疫によるものなのか? 現在のところ状況証拠しかないが,理由の一つであると考えられている。シンガポールは,感染者数は約6万人と多いにもかかわらず,世界でもっとも致死率の低い国の一つ(2021年1月9日現在の死者数29人)として知られている。そのシンガポールからの報告では,COVID-19から回復した患者全員の血液から,SARS-CoV-2のRNAを覆う殻(カプシド)の部分にあたる「ヌクレオカプシド(N)蛋白質」に反応するヘルパーT細胞,キラーT細胞が見つかった。また,非感染者でもT細胞の交差反応がみられた12)。彼らは,S蛋白質以外の,感染早期に発現するウイルス粒子に組み込まれない蛋白質(non-structural protein,非構造ウイルス蛋白質)を中心に調べたところ,非構造ウイルス蛋白質であるNSP7 やNSP13などのペプチドに対して交差反応を示すキラーT細胞が存在することを示した。このようなキラーT細胞は,ウイルスが感染細胞内で猛烈に複製する前に細胞を殺傷するので,無症状か軽症のままですむのではないかと考察している。しかし非感染者のT細胞応答はやはり4割程度であり,米国とシンガポールにおける,人口当たりの致死率・重症化率の地域差は説明できない。さらにこの論文では,シンガポールでは別の動物由来のコロナウイルスが流行していた可能性を指摘している。
・日本人非感染者におけるヘルパーT細胞の応答
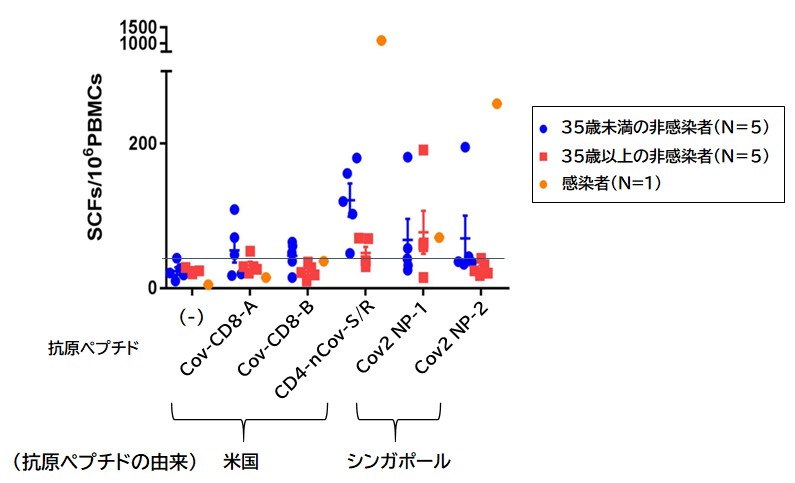
我々は米国とシンガポールのグループから抗原ペプチドを分与してもらい,日本人非感染者におけるヘルパーT細胞の応答をELISPOTアッセイにより調べた。N=10と少数であるため,結論づけることは難しいが,やはり非感染者の4~6割程度に反応が見られた(図4)。この割合は米国と変わらないため,T細胞の交差免疫による地域差(ファクターX)を説明することは難しいと考えられる。しかし,興味深いことに35歳以下の若齢者ではT細胞の反応が強く,35歳以上の被験者の反応は弱かった。この結果から,高齢者に比して若齢者が軽症な理由(ファクターY)は,T細胞の交差免疫で説明できる可能性がある。しかしT細胞の交差免疫を検出したのは,あくまで試験管のなかでの話である。実際に,身体のなかでSARS-CoV-2を撃退する効果があるか,重症化させない鍵になっているのかどうかを結論することは時期尚早であろう。
現在のところ,蔵野博士らも抗体の交差免疫パターンを示す症例が重症化しにくいという統計的な差は見られていないとしており7),年齢別にデータを見直すなどの検証が必要であろう。我々もシンガポールから入手したウイルス抗原ペプチドを用いて,日本人検体(N=10)のキラーT細胞の交差免疫応答についても調べた。その結果,キラーT細胞はシンガポールからの報告のような高い反応を示さなかった。この結果からも,若者が重症化しない原因が交差免疫であると早計に結論づけることはできない。
今後の展望
SARS-CoV-2と風邪コロナウイルスとのあいだの交差免疫は確実に存在する。しかし,これが若者や小児が軽症あるいは無症状であることの原因となっているかどうかについては,さらに詳細な解析が待たれる。一方,このような交差免疫はワクチン開発に有用であると考えられる。多くの人で交差免疫を示すウイルスの抗原ペプチドを見つけることができれば,それを投与することによりT細胞とB細胞の記憶がよび起こされて,非常に効果的な免疫応答を引き起こす可能性がある。
文献
- 1) Tosif S, Neeland MR, Sutton P, et al. Immune responses to SARS-CoV-2 in three children of parents with symptomatic COVID-19. Nat Commun 2020; 11: 5703.[PubMed]
- 2) 国立感染症研究所.コロナウイルスとは.
https://www.niid.go.jp/niid/ja/kansennohanashi/9303-coronavirus.html[2021年2月1日閲覧] - 3) Ng KW, Faulkner N, Cornish GH, et al. Preexisting and de novo humoral immunity to SARS-CoV-2 in humans. Science 2020; 370: 1339-1343.[PubMed]
- 4) Sagar M, Reifler K, Rossi M, et al. Recent endemic coronavirus infection is associated with less-severe COVID-19. J Clin Invest 2021; 131: e143380.[PubMed]
- 5) Edridge AWD, Kaczorowska J, Hoste ACR, et al. Seasonal coronavirus protective immunity is short-lasting. Nat Med 2020; 26: 1691-1693.[PubMed]
- 6) Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020; 579: 270-73.[PubMed]
- 7) 日本医師会 COVID-19有識者会議.日本人における新型コロナウイルスIgM、IgG、IgA.
https://www.covid19-jma-medical-expert-meeting.jp/topic/3891[2021年2月1日閲覧] - 8) Huang AT, Garcia-Carreras B, Hitchings MDT, et al. A systematic review of antibody mediated immunity to coronaviruses: kinetics, correlates of protection, and association with severity. Nat Commun 2020; 11: 4704.[PubMed]
- 9) Grifoni A, Weiskopf D, Ramirez SI, et al. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell 2020; 181: 1489-1501.e15.[PubMed]
- 10) Mateus J, Grifoni A, Tarke A, et al. Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans. Science 2020; 370: 89-94.[PubMed]
- 11) Braun J, Loyal L, Frentsch M, et al. SARS-CoV-2-reactive T cells in healthy donors and patients with COVID-19. Nature 2020; 587: 270-74.[PubMed]
- 12) Le Bert N, Tan AT, Kunasegaran K, et al. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature 2020; 584: 457-62.[PubMed]