第2回(2020.12.24)COVID-19の病態としての免疫異常と血栓症
岐阜市民病院第1内科
西垣和彦
2019年12月31日,未知の呼吸器疾患である新型コロナウイルス感染症が中国の武漢で最初に流行し,報告された1)。それはすぐに新型のベータコロナウイルスと同定され,コウモリからヒトへの伝播が示唆された2)。2020年1月30日,世界保健機関(WHO)は,新型コロナウイルスの流行に関し,「国際的に懸念される公衆衛生上の緊急事態(PHEIC)」であることを宣言した。2月11日,WHOはこの疾患の病態をCOrona VIrus Disease 2019(COVID-19)と命名し,3月2日,国際ウイルス分類委員会により,このウイルスはSARS-CoV-2と正式に命名された。その後,SARS-CoV-2は東南アジアだけでなくヨーロッパや北米にも急速に広がり,WHOは3月11日にCOVID-19のパンデミックを公式に宣言した。
2020年12月20日現在,全世界191ヵ国で約7,600万人以上が感染し,死亡者は約168万人と報告されている3)。現在,わが国でも第2波が収束せぬうちに第3波に突入しており,これまでにPCR陽性者数19.5万人,入院治療を要する患者数2.6万人と急激に増加中である。一方,現時点での死亡者数は2,873人と,欧米と比較してかなり抑制されている。しかし,今後は基礎疾患が多く致死率が高い高齢者への急激な感染拡大が危惧されており,予断を許さない状況にあるのが現状である。
本稿では,COVID-19における“免疫異常と血栓症”に関して概説する。
免疫的防御機構と血栓形成
・感染による免疫血栓の形成とDIC
炎症は,体内に侵入してくる微生物を制御し,損傷した組織を治癒させるために不可欠な宿主の反応である。多くの炎症性疾患では,制御されていない持続的な炎症により組織の損傷が引き起こされる。生体では,微生物が体内に侵入すると免疫系が働き,生理的反応として全身への感染を予防し抑え込むために全身に血栓形成が惹起される。これを,生理的な防御機構の意味で「免疫血栓(immunothrombosis)」という。
しかし,微生物の侵襲があまりにも強烈な場合,免疫血栓形成が過剰に促進されて全身の微小血管を閉塞する微小血栓となり,最終的には敗血症性の播種性血管内凝固症候群(DIC)という状態に陥る4)。
・NETsによる血栓形成のメカニズム
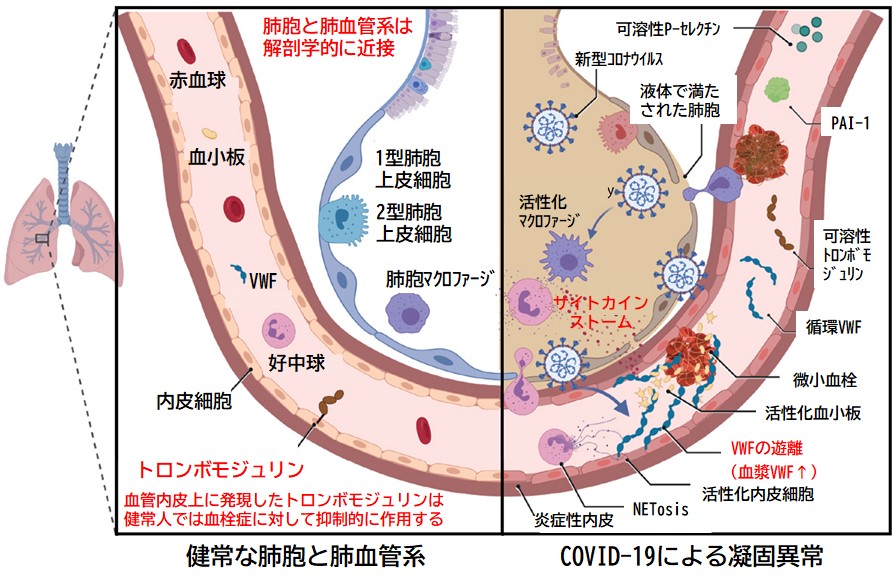
健康な肺胞と肺血管系は解剖学的に隣接しており,血栓症は細胞膜表面のトロンボモジュリンを発現する内皮細胞によって予防されているが,COVID-19では,前炎症性サイトカイン,低酸素,補体活性化,および好中球細胞外トラップ(NETs)を含む複数の経路を介して,内皮細胞の活性化と損傷が惹起される5)。
好中球は急性炎症時に優勢となる白血球である。好中球は感染部位に遊走・集積し活性化され,活性化好中球になると,細菌を貪食して活性酸素を産生し,細菌を殺すことで感染防御に大きく寄与する。さらに,活性化好中球は,ほかの細胞とは異なり,核内のクロマチンを細胞外に放出して,網状の細胞内顆粒成分とクロマチンDNAからなるクロマチン網のNETsを形成する6)。この過程はネクローシスやアポトーシスとは異なるタイプの細胞死ということで,NETosisと名付けられている。
NETsは網状となり局所に留まって細菌を捉える。捉えられた細菌は好中球やマクロファージに貪食されやすくなり,また,NETsそのものにも殺菌作用がある。さらに,NETsは血小板を捕捉して活性化し,血栓形成に重要な働きをする。しかし,劇症化した感染症によりNETsが不適切に放出され,好中球のNETosisが過剰発現すると,NETs上に存在する高濃度のヒストンなど各種抗菌蛋白により直接的な細胞毒性,炎症性が活性化される。さらに好中球血小板複合体が形成され,毛細血管内で過剰に血栓が形成されることにより宿主細胞に害を与え,炎症や血栓症を助長させる結果となる。
・内皮細胞の損傷
ウイルス感染の結果,これらの内皮細胞の活性化と損傷から,内皮細胞からのワイベル・パラード体の開口分泌が引き金となり,超大型のフォン・ヴィレブランド因子(VWF)重合体とP-セレクチンが放出される(図1)5)。そして,VWFが遊離し,活性化血小板,好中球,単球と結合して微小血管血栓症を引き起こす。同時に,線溶系の要の一つであるトロンボモジュリンが内皮細胞表面から引き抜かれ,凝固および炎症の局所的な環境をさらに促進する。最後に,内皮細胞の損傷は,基底膜からの分離と隣り合う上皮細胞を強固に接着する密着結合の破壊をもたらし,結果として血管透過性が高まることとなる。
・サイトカインストーム
ウイルスが肺胞に侵入すると,単球やマクロファージといった免疫細胞から炎症性サイトカインが分泌され,免疫系の制御がきかなくなり,炎症性サイトカインが過剰分泌されてサイトカイン放出症候群(サイトカインストーム)となる。複数のプロセスがCOVID-19関連凝固症に寄与していると考えられるが,これには,2型肺胞上皮細胞および内皮細胞への直接感染が含まれ,バリア機能障害および透過性の亢進をもたらす。T細胞,好中球,単球,マクロファージ,および血小板の活性化によって特徴づけられる炎症反応では,炎症性サイトカイン放出(インターロイキン[IL]-1,IL-6,IL-10,腫瘍壊死因子[TNF]-αを含む),単球由来の組織因子(TF)およびプラスミノーゲンアクチベーターインヒビター1(PAI-1)の発現,フィブリン,前述したNETs,および血小板からなる微小血栓が,微小血管のみならず大血管にまでも血栓症を発現させる。
・IL-6は凝固を促進する
免疫細胞からのIL-6の放出は,ヘルパーT細胞(Th細胞)のサブセットの一つであるTh17細胞の分化を伴うシグナルとなる。Th17細胞は,自己免疫疾患の病態形成に密接に関与している。また,IL-6は内皮細胞のような多くの細胞型におけるトランスシグナルをもたらす増幅カスケードを誘発する。
重度の炎症では,IL-6が凝固の活性化に寄与し7),結果として生じる全身性サイトカイン産生の増加は,低血圧および急性呼吸窮迫症候群(ARDS)を含む重度のCOVID-19の病態生理に寄与する8)。
・内皮性血栓性炎症症候群
このような病態から,COVID-19の新たな名称として,微小血管COVID-19肺血管閉塞性血栓性炎症症候群(MicroCLOTS)が提唱された9)。これは,ウイルスによる肺胞への損傷が炎症反応に続いて微小血管肺血栓症を引き起こすという意味から名づけられたものであるが,この進行性の微小血管血栓症は,肺に限らず脳などのほかの重要な臓器の微小血管床にも関与し,多臓器不全や死に至る可能性があることから,現在ではCOVID-19の病態を「内皮性血栓性炎症症候群」とするのが妥当である。
COVID-19における血栓症の臨床
・各国の状況
ブラジルのサンパウロからの計10例の剖検では,肺胞および小気道上皮を巻き込んだ滲出性/増殖性のびまん性肺胞損傷が認められ,リンパ球浸潤はほとんど認められなかった。しかし,大多数で肺実質の損傷部位と健常部位の両方に小肺動脈内のフィブリン性微小血栓が認められた(図2)10)。
循環器領域では,COVID-19による多量の血栓で左冠動脈前下行枝が完全閉塞し,ショックとなった急性心筋梗塞(AMI)症例11)や,遅発性冠動脈ステント血栓症の症例も報告12)されているが,2019年の同時期と比較して,AMIの入院患者数が39.5%減少したことがフランスから報告されている13)。一方,COVID-19のAMI患者の約40%は,緊急冠動脈造影で責任病変が特定できないことがイタリアから報告された14)。さらにCOVID-19のパンデミック期間中には,急性冠症候群(ACS)に臨床的に類似した“たこつぼ心筋症”(ストレス性心筋症)の発症率が有意に増加したことが報告され15),今後のACSに対する対応が憂慮されている。
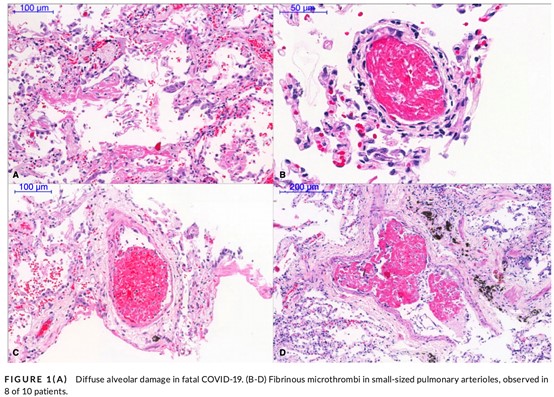
COVID-19で死亡した患者の剖検所見。(A)びまん性肺胞損傷,(B-D)小肺動脈 のフィブリン性微小血栓が10人中8人に観察された
・血栓症の発症頻度
静脈血栓塞栓症の頻度は,重症患者で25%と報告されており,予後不良に関連することが報告されている16)。また,動脈血栓については,COVID-19患者では少なくとも1つの血栓を動脈内に認め,94%に近位部血栓を認めたとも報告されている17)。一般的にCOVID-19で動脈・静脈血栓症を認める頻度は31%と高率であり18),COVID-19の病態の特徴と考えられる。
COVID-19における血栓性心筋傷害
・心筋への影響
COVID-19は,直接的および間接的に心臓に損傷を与え,心筋細胞の断片化,収縮メカニズムの破壊や,曝露後72時間以内に心筋アポトーシスと拍動停止をもたらすことが報告されている19)。このような心筋細胞への直接傷害のほか,心血管などの内皮細胞へのウイルスの侵入による二次的な免疫反応(内皮炎)が惹起される。さらに,微小血管~大血管だけでなく心筋内にも微小血栓が認められる。季節性インフルエンザと比較して,COVID-19では虚血性変化を伴わなくとも非閉塞性フィブリン性微小血栓が高頻度で確認されている20)。このことは,たとえ心電図などで心筋虚血の所見を認めなくても,冠動脈の微小循環レベルで微小血栓は存在していると考えて治療すべきであることを示唆している。
・バイオマーカー
急性虚血性変化を心電図あるいは心エコーで認めるか否かに関わらず,心筋傷害を,心臓壁を構成する心筋の横紋筋細胞の蛋白成分で,早期心筋傷害のマーカーである血清トロポニンの上昇と定義すると,血栓症発生率は7~40%であり,院内合併症の増加と関連しており,一方,心筋トロポニンの上昇は,炎症性バイオマーカー(フェリチン,IL-6,C反応性蛋白[CRP]など)や凝固バイオマーカー(Dダイマーなど),低酸素血症,呼吸器疾患の重症度(酸素/吸気酸素比の低下,機械的人工呼吸の必要性など)の上昇と相関している21)。なお,トロポニンの上昇は院内死亡率増加とも関連しており,併存する心臓の基礎疾患とは無関係であったと報告されている22)。
COVID-19における凝固・線溶パラメータの推移
・COVID-19におけるDICは線溶亢進型を呈する
凝固パラメータを後ろ向きに解析した報告では,死亡例における凝固線溶系検査所見の特徴として,プロトロンビン時間(PT)の延長,Dダイマーの上昇,フィブリン分解産物(FDP)の上昇と,凝固系の活性化とともに著しい線溶活性化が認められ,COVID-19における播種性血管内凝固症候群(DIC)は,線溶亢進型を呈することが報告されている23)。
重症患者では,血小板減少症(<100×109/L)の発生率が有意に高い一方,リンパ球数と好酸球数は重症患者で有意に少なく,PT,Dダイマー,FDPは重症度の増加に伴って有意に増加することが報告されている。多変量解析では,死亡は好中球:リンパ球比増加(≧9.13),血小板減少症(<100×109/L),PT延長(>16秒),Dダイマー増加(>2 mg/L)に関連し,重症度および予後を評価するのに役立つと考えられる24)。
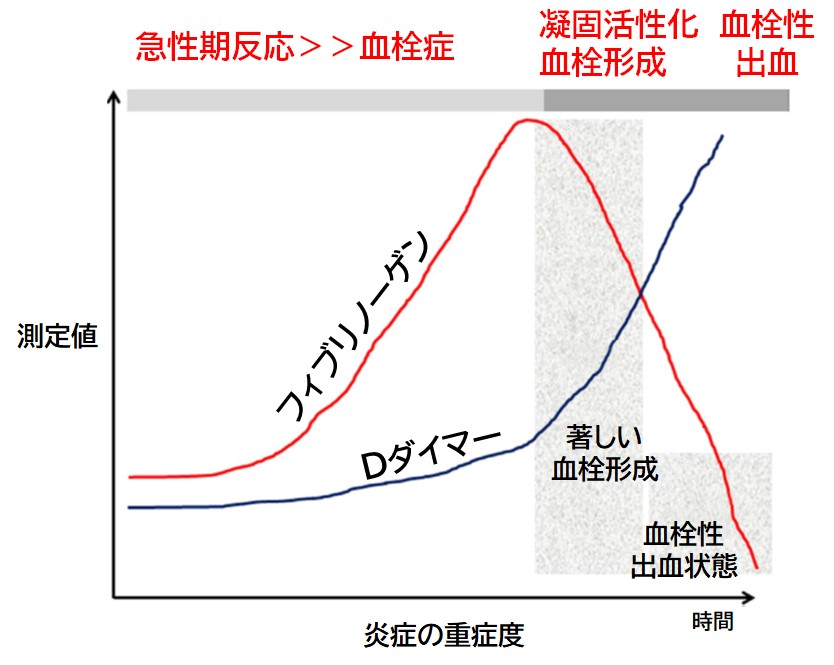
・Dダイマーとフィブリノーゲン
重症患者でDダイマーとともにフィブリノーゲン(FIB)を測定することは重要である。DダイマーがFIBと連動して増加しない場合,FIBの保護的役割が支配的であるという仮説が立てられる(急性期反応>>血栓症)。一方,Dダイマーが増加し始め,FIBレベルが減少し始めると,著しい凝固活性化と血栓形成が起こっている時期であると評価できる(図3)25)。
COVID-19における抗血栓療法
・ヘパリン
COVID-19の臨床経過は,①ウイルス侵入,②サイトカインストーム,③血栓症期,の3期に分けられ26),ステージごとに治療法を変える必要があるが,抗血栓療法はどのステージにおいても考慮されるべきである。
ヘパリンは,抗凝固作用のほかに,抗ウイルス作用,抗炎症作用も併せ持つことが知られている27)。細胞表面のヘパラン硫酸プロテオグリカンは,コアタンパク質と多糖類の側鎖を含んでおり,凝固活性や炎症反応,ウイルスの標的細胞への侵入など,幅広い機能の維持・調節に不可欠な役割を果たしている。したがってヘパリンは,アンチトロンビンと結合することでXa凝固因子を阻害して抗凝固作用を示すだけでなく,SARS-CoV-2の棘状のスパイク蛋白(S蛋白)に結合することで宿主細胞への侵入を阻止し,ケモカインや損傷組織・壊死に向かっている細胞から放出される微粒子,ダメージ関連分子パターン(DAMPs)と結合・吸着することで,免疫反応を緩和することが期待できる28)。ランダム化比較試験では,28日死亡率はヘパリン使用の有無で差を認めなかったが,敗血症誘発性凝固障害(SIC)スコア≧4,またはDダイマーが正常値の上限の6倍以上の患者では,ヘパリン使用で28日死亡率が減少することが報告された29)。ただし,ヘパリン類(カルシパリン,フォンダパリヌクス,エノキサパリン)を予防的用量と治療用量に分けてその効果を比較した報告では,治療用量の投与は死亡率に関連する15の交絡因子を調整しても生存率の改善とは関連せず,高用量のヘパリンを定常的に用いることは推奨されない結果となった30)。
さらに,抗血栓療法(抗凝固療法または抗血小板療法)の有効性に関して,COVID-19と診断されたタイミングですでに抗血栓療法が行われていた症例の予後を検討した報告では,生存期間および機械的換気に至るまでの日数は,統計学的に有意差を認めなかった31)。一方,治療用量の抗凝固薬投与は,院内死亡率を軽減しなかったが,生存期間中央値を有意に延長し,機械換気を必要とした重症患者の院内死亡率を大幅に減少させたとする報告がある32)。患者背景に違いがあり単純に比較できないが,より血栓傾向が強く出血傾向がみられないステージでの使用は有効と考えられる。
・DOAC
直接作用型経口抗凝固薬(DOAC)の有効性に関しては各社で検討中であるが,アピキサバンとエノキサパリンに関し,予防的用量で死亡率は有意に減少し,とくにDダイマーが1 μg/mL未満の患者では有効ではなかったが,10 μg/mLを超える患者ではもっとも有効であったと報告されている33)。
一方,抗血小板薬の投与についても,アスピリンの使用は人工呼吸器を使用するリスクを44%,ICUへの入院リスクを43%,入院中死亡リスクを47%減少させたが,入院中の大出血などの有害事象の有意な増加は見られなかったと報告されている34)。
おわりに
COVID-19の病態の本質である“免疫異常と血栓症”に関して概説した。
COVID-19では,高齢者と比較し若年者の多くが軽症である。死亡率が39歳以下では0.2%ときわめて少ないが,高齢者ではきわめて重症化しやすく,80歳以上では14.8~20.2%と死亡率が高いことが報告されている35)。基礎疾患によって死亡率に差があり,心血管疾患合併で10.5%,糖尿病合併で7.3%,慢性呼吸器疾患合併で6.3%,高血圧合併で6%と,循環器疾患領域で高い死亡率が報告されていることから36),循環器内科医にとってCOVID-19は将来を左右しかねない重大な疾患と位置付けられる。今後,COVID-19に対し適切かつ有効な治療法を選択し施行するためにも,循環器内科医においても免疫系や凝固線溶系の知識のさらなる蓄積と,循環器内科の視点からの継続的な研究が必要と考えられる。
文献
- 1) "内地疑爆發「新SARS」武漢海鮮市場7人染肺炎需隔離". skypost.ulifestyle.com.hk (中国語). 2020年1月2日閲覧.
- 2) Lu R, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 2020; 395(10224): 565–574.[PubMed]
- 3) COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU).https://gisanddata.maps.arcgis.com/
- 4) 伊藤隆史.播種性管内凝固症候群(DIC).血栓と循環 2015; 23(2): 7-13.
- 5) O'Sullivan JM, Gonagle DM, Ward SE, et al. Endothelial cells orchestrate COVID-19 coagulopathy. Lancet Haematol 2020; 7(8): e553-e555.[PubMed]
- 6) Jiménez-Alcázar M, Rangaswamy C, Panda R, et al. Host DNases prevent vascular occlusion by neutrophil extracellular traps. Science 2017; 358(6367): 1202-1206.[PubMed]
- 7) Stouthard JM, Levi M, Hack CE, et al. Interleukin-6 stimulates coagulation, not fibrinolysis, in humans. Thromb Haemost 1996; 76(5): 738-42.[PubMed]
- 8) Moore JB,and June CH. Cytokine release syndrome in severe COVID-19. Science 2020; 368(6490): 473-474.[PubMed]
- 9) Ciceri F, Beretta L, Scandroglio AM, et al. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory distress syndrome working hypothesis. Crit Care Resusc 2020; 22(2): 95-97.[PubMed]
- 10) Dolhnikoff M, Duarte-Neto AN, Renata Aparecida de Almeida Monteiro, et al. Pathological evidence of pulmonary thrombotic phenomena in severe COVID-19. J Thromb Haemost 2020; 18(6): 1517-1519.[PubMed]
- 11) Harari R, Bangalore S, Chang E, et al. COVID-19 complicated by acute myocardial infarction with extensive thrombus burden and cardiogenic shock. Catheter Cardiovasc Interv 2020; May 19; 10.1002/ccd.28992.[PubMed]
- 12) Antuña P, Rivero F, Val DD, et al. Late Coronary Stent Thrombosis in a Patient With Coronavirus Disease 2019. JAMA Cardiol 2020; 5(10): 1195-1198.[PubMed]
- 13) Matsushita K, Hess D, Marchandot B, et al. Clinical features of patients with acute coronary syndrome during the COVID-19 pandemic. J Thromb Thrombolysis 2020 Nov 16; 1-10.
- 14) Stefanini GG, Montorfano M, Trabattoni D, et al. ST-Elevation Myocardial Infarction in Patients With COVID-19: Clinical and Angiographic Outcomes. Circulation. 2020; 141(25): 2113-2116.[PubMed]
- 15) Jabri A, Kalra A, Kumar A, et al. Incidence of Stress Cardiomyopathy During the Coronavirus Disease 2019 Pandemic. JAMA Netw Open 2020; 3(7): e2014780.[PubMed]
- 16) Cui S, Chen S, Li X, et al. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost 2020; 18(6): 1421-1424.[PubMed]
- 17) Goldman IA, Ye K, Scheinfeld MH, et al. Lower-extremity Arterial Thrombosis Associated with COVID-19 Is Characterized by Greater Thrombus Burden and Increased Rate of Amputation and Death. Radiology 2020; 297(2): E263-E269.[PubMed]
- 18) Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res 2020; 191: 145-147.[PubMed]
- 19) Topol EJ. COVID-19 can affect the heart. Science 2020; 370(6515): 408-409.[PubMed]
- 20) Bois MC, Boire NA, Layman AJ, et al. COVID-19-associated Non-Occlusive Fibrin Microthrombi in the Heart. Circulation 2020 Nov 16. doi: 10.1161/CIRCULATIONAHA.120.050754. Online ahead of print. [PubMed]
- 21) Giustino G, Pinney SP, Lala A, et al. Coronavirus and Cardiovascular Disease, Myocardial Injury, and Arrhythmia: JACC Focus Seminar. J Am Coll Cardiol 2020; 76(17): 2011-2023.[PubMed]
- 22) Lombardi CM, Carubelli V, Iorio A, et al. Association of Troponin Levels With Mortality in Italian Patients Hospitalized With Coronavirus Disease 2019: Results of a Multicenter Study. JAMA Cardiol 2020; 5(11): 1274-1280.[PubMed]
- 23) Tang N, Li D, Wang X, et al. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 2020; 18(4):844-847.[PubMed]
- 24) Liao D, Zhou F, Luo L, et al. Haematological characteristics and risk factors in the classification and prognosis evaluation of COVID-19: a retrospective cohort study. Lancet Haematol 2020; 7(9): e671-e678.[PubMed]
- 25) Thachil J. The protective rather than prothrombotic fibrinogen in COVID-19 and other inflammatory states. J Thromb Haemost 2020; 18(8): 1849-1852.[PubMed]
- 26) Pons S, Fodil S, Azoulay E, et al. The vascular endothelium: the cornerstone of organ dysfunction in severe SARS-CoV-2 infection. Crit Care 2020; 24(1): 353.[PubMed]
- 27) Hippensteel JA, LaRiviere WB, Colbert JE, et al. Heparin as a therapy for COVID-19: current evidence and future possibilities. Am J Physiol Lung Cell Mol Physiol 2020; 319(2): L211-L217.
- 28) Liu J, Li J, Arnold K, et al. Using heparin molecules to manage COVID-2019. Res Pract Thromb Haemost 2020; 4(4): 518-523.[PubMed]
- 29) Tang N, Bai H, Chen X, et al. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost 2020; 18(5): 1094-1099.[PubMed]
- 30) Bolzetta F, Maselli M, Formilan M, et al. Prophylactic or therapeutic doses of heparins for COVID-19 infection? A retrospective study. Aging Clin Exp Res 2020 Nov 16; 1-5.[PubMed]
- 31) Tremblay D, Gerwen MV, Alsen M, et al. Impact of anticoagulation prior to COVID-19 infection: a propensity score-matched cohort study. Blood 2020; 136(1): 144-147.[PubMed]
- 32) Paranjpe I, Fuster V, Lala A, et al. Association of Treatment Dose Anticoagulation With In-Hospital Survival Among Hospitalized Patients With COVID-19. J Am Coll Cardiol 2020; 76(1): 122-124.[PubMed]
- 33) Billett HH, Reyes-Gil M, Szymanski J, et al. Anticoagulation in COVID-19: Effect of Enoxaparin, Heparin, and Apixaban on Mortality. Thromb Haemost 2020 Nov 13. doi: 10.1055/s-0040-1720978. Online ahead of print. [PubMed]
- 34) Chow JH, Khanna AK, Kethireddy, S et al. Aspirin Use is Associated with Decreased Mechanical Ventilation, ICU Admission, and In-Hospital Mortality in Hospitalized Patients with COVID-19. Anesth Analg 2020 Oct 21. doi: 10.1213/ANE.0000000000005292. Online ahead of print.[PubMed]
- 35) Epidemiology Working Group for NCIP Epidemic Response, Chinese Center for Disease Control and Prevention. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China. Zhonghua Liu Xing Bing Xue Za Zhi. 2020; 41(2): 145-151.[PubMed]
- 36) Wu Z, Jennifer M. McGoogan, et al: Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China. Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. JAMA 2020; 323(13): 1239-1242.[PubMed]