第4回(2021.1.27)新型コロナウイルスの感染と
サイトカイン応答
千葉大学真菌医学研究センター感染免疫分野
米山光俊
COVID-19パンデミックは,世界に未曾有の災害をもたらしている。この感染症の特徴は,SARS-CoV-2に感染しても,感染者の80%が無症状か軽症であり,感染を広げる可能性がある一方で,一部の高齢者や基礎疾患をもつ人は重症化し,死に至る危険があることである。したがって,感染拡大の抑止とワクチンによる集団免疫の確立と並行して,重症化の理解と対策が重要な課題である。
一般的に,ウイルスは宿主細胞へ感染して増殖するため,感染症の発症と重症化は,それぞれのウイルストロピズム(ウイルスと宿主細胞の親和性)と増殖様式,ウイルス–宿主相互作用に加え,宿主側の感染応答の制御バランスなどの影響を受ける。COVID-19の場合,感染初期の抗ウイルス応答の減弱とその後の免疫応答の暴走が,疾患の重症化に深く関与することが示唆されている。本稿では,SARS-CoV-2の増殖様式と,感染に対する免疫応答の制御とその破綻について,自然免疫系を中心に基礎的な観点から概説する。
SARS-CoV-2
・SARS-CoV-2の感染
SARS-CoV-2は,コロナウイルス科・オルソコロナウイルス亜科・ベータコロナウイルス属に属するエンベロープを持つRNAウイルスであり,ゲノムは29,903塩基のプラス鎖一本鎖RNAである。感染は,コロナウイルスの特徴であるエンベロープ上に突出するスパイク(S)タンパク質が,宿主細胞膜上のangiotensin-converting enzyme 2(ACE2)と結合し,複数の宿主プロテアーゼによるSタンパク質の開裂を経てゲノムRNAが細胞内へ侵入することにより起こる。また,エンドソームを経て侵入する経路も知られる。したがって,これら宿主因子の発現がウイルストロピズムを決定すると考えられる1)。
・SARS-CoV-2の宿主細胞内での増殖
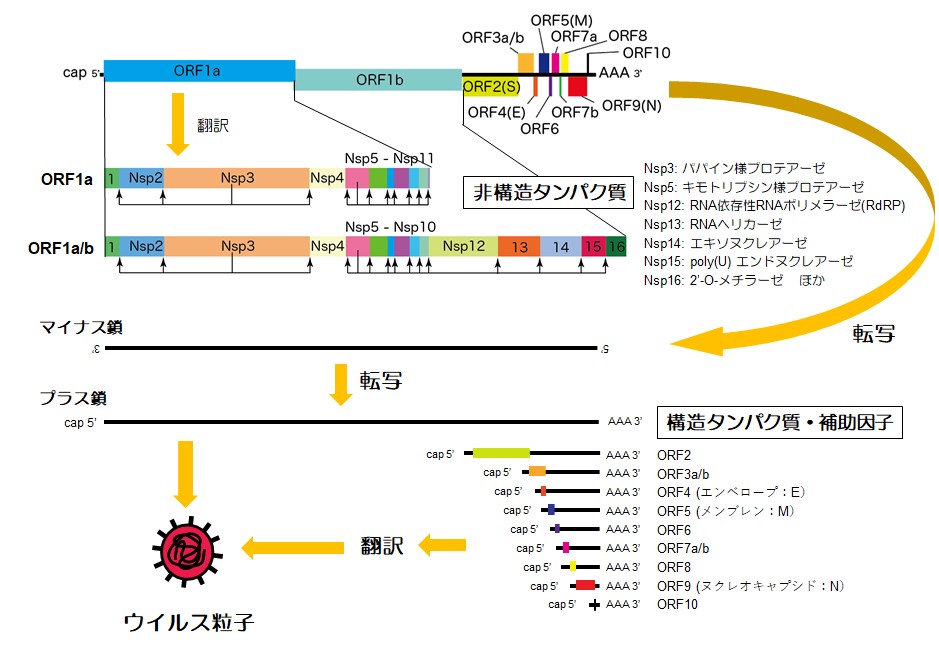
細胞内にウイルスRNAが侵入すると,5’末端にcap構造を持つプラス鎖RNAゲノムはそのままmRNAとして機能し,宿主の翻訳機構を利用してウイルスタンパク質を合成する。ゲノムサイズが大きいコロナウイルスは,多様なウイルスタンパク質をコードする(図1)。最初に翻訳されるopen reading flame(ORF)1aと1a/bは巨大なポリプロテインであり,そこにコードされる2つのプロテアーゼNsp3とNsp5による限定分解によって,16の非構造タンパク質(Nsp)が生成される。その中にはRNA依存性RNAポリメラーゼ(Nsp12)などの複製に関与するタンパク質が含まれ,ウイルスゲノムRNAの複製と残る9つのORF mRNAが転写され,そこから翻訳される構造タンパク質とプラス鎖ウイルスRNAがウイルス粒子を形成し,放出される。これらのウイルス感染・増殖様式から,ウイルスの接着と融合の阻害(モノクローナル抗体,ナファモスタット*),ポリプロテイン分解阻害,RNA合成阻害(レムデシビル,ファビピラビル[商品名: アビガン])を標的とした薬剤が承認あるいは検討されている。
*ナファモスタット(商品名: フサン)はカモスタットともに急性膵炎の治療に用いられるセリンプロテアーゼ阻害薬。SARS-CoV-2のSタンパク質と宿主細胞の細胞膜との融合に関与しているセリンプロテアーゼ(TMPRSS2)を阻害することで,ウイルスの侵入を抑制する可能性が示唆されている。
ウイルスに対する宿主の自然免疫系
・ウイルスを認識するセンサー分子
宿主感染細胞では,侵入したウイルスRNAを非自己として検知することで自然免疫系を発動させる。自然免疫において病原体感染を検知するのは,パターン認識受容体(PRRs)とよばれるセンサー分子群である2, 3)。コロナウイルスの場合,エンドソーム内に取り込まれたウイルスRNAは,Toll様受容体(TLR)のうちRNAを特異的に認識するTLR3(二本鎖RNA)とTLR7/8(一本鎖RNA)により検知される。また,感染細胞へ注入されたRNAは,細胞質ウイルスRNAセンサーであるRIG-I様受容体(RLR: RIG-IならびにMDA5)によって検知される。
・炎症性サイトカインとインターフェロンの誘導
いずれのPRRも,下流シグナル誘導により転写因子NF-κBならびにIFN regulatory factor(IRF)-3/7を活性化し,インターロイキン-6(IL-6)や腫瘍壊死因子(TNF)などの炎症性サイトカインに加え,抗ウイルスサイトカインであるインターフェロン(IFN)を誘導する。感染初期に誘導されるIFNは,I型(13種のIFN-αおよびIFN-βなど)ならびにIII型(4種のIFN-λ)であり,それぞれが異なる受容体と結合するが,下流では共通してヤヌスキナーゼ(JAK)による転写因子STAT1/2の活性化を介して,多様なIFN誘導遺伝子群(ISG)が誘導され,感染細胞や周囲の細胞へ抗ウイルス活性をもたらす。また,免疫系細胞の活性制御を介して,ウイルス感染細胞の除去とその後の獲得免疫の調節にも深く関与する。なお,ACE2もISGであることが示されており,IFN系はSARS-CoV2の侵入を増強する可能性がある一方で,レニン-アンジオテンシン系の制御を介した組織保護に関与することが示唆される4)。
・インターフェロンは疾患の増悪にも関与している
IFNシステムは,多くのRNAウイルス感染症において,感染最前線でのウイルス排除に必須であると考えられるが,コロナウイルス感染症においては,ウイルス排除に加えて疾患増悪にも関与し得ることが示されている。たとえば,マウスにおける経鼻SARS-CoV感染実験では,感染初期のIFN誘導は減弱しているものの,IFN投与により病態を緩和させることができる。しかし,遅延して誘導されるIFNは,ケモカイン遺伝子の発現と肺への炎症性単球の動員などを介して致死的な肺炎を誘導することが示されている5)。このIFN系の減弱と疾患重症化の関連は,SARS-CoV-2感染でも報告されている6, 7)。
また,COVID-19患者コホートにおける病態別の経時的な解析では,軽症患者では初期のIFN誘導とその後の速やかな発現減弱がみられるのに対し,重症患者では病態の悪化とともに血中IFN量の増加が観察され,感染後期のIFN誘導はウイルス排除に寄与できず,むしろ病態の悪化に関与している可能性がある8)。これらの知見は,コロナウイルス感染症ではIFNの感染初期の誘導とその後の速やかな減弱が重症化阻止に重要であることを示唆している。
一方で,血中に存在する抗IFN中和抗体が感染後のウイルス排除低下と重症化に関連する可能性があること9, 10),また,一部のCOVID-19重症患者においてIFN系のシグナル分子の遺伝子座に先天的変異があることが示されており11),IFN系による感染初期のウイルス排除が,COVID-19重症化の抑制に重要であることが示されている。なお,男性は女性に比べて,抗IFN中和抗体をもつ人が多く,重症化の性差を説明する一つの要因であることも示唆されている9)。
・COVID-19患者に対するIFNの投与
これらの知見を背景に臨床的なIFN投与が検討・実施されており,いくつかの報告では一定の効果がみられている12)。ただ,上記のように感染初期と発症後ではIFNの効果が異なる可能性があることから,使用のタイミングや量に慎重な検討が必要であると考えられる。また,III型IFNはその受容体発現が上皮細胞などに限られることから,感染局所でのウイルス抑制効果に期待した検討もなされているが2),III型IFNが肺での病態増悪に関与するとの報告もあり13),同じく慎重な検討が必要である。
・SARS-CoV-2によるIFN誘導の抑制
SARS-CoV-2によるIFN誘導の抑制機構についても,多くの解析がなされつつある14)。詳細は触れないが,複数のNspやORFが,PRRによるウイルスRNA認識やIFN誘導およびIFN受容体を介したシグナル経路を阻害することが報告されつつある(図2)。これらの分子機構の解明を通じて,IFN系誘導を標的とした新たな創薬の可能性が期待される。
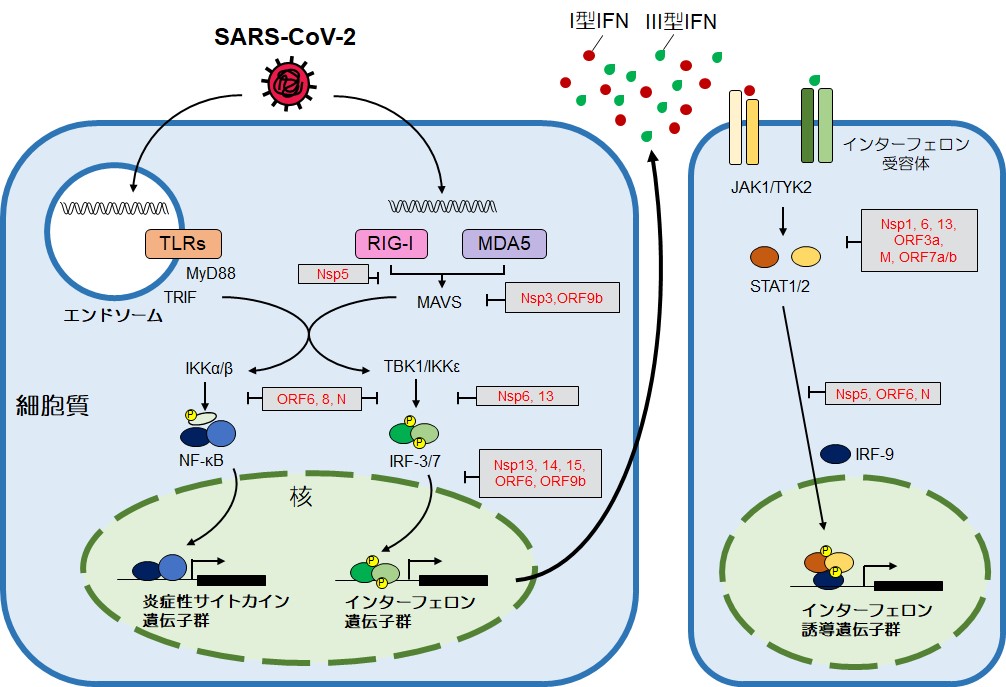
SARS-CoV-2がコードする複数のウイルスタンパク質(図中の赤字)は,自然免疫系のシグナル伝達を阻害する(M: メンブレン,N: ヌクレオキャプシド)
サイトカインストーム
・サイトカインストームとは
自然免疫系によるウイルス排除とその後の獲得免疫系誘導により,ウイルス感染症の発症は阻止されることが期待される。SARS-CoV-2感染においても,多くの感染者が無症状か軽症であることなどから,ほとんどの場合は適切な免疫応答によるウイルス排除が行われていることが示唆される。しかし,IFN系の不十分な誘導によるウイルス増殖は,高齢者などでいわゆる「サイトカインストーム」とよばれる免疫応答の暴走をもたらし,重症化につながる可能性がある。サイトカインストームは,1993年の移植片対宿主病に関する論文での記述が最初とされているが15),その後インフルエンザウイルスや敗血症を含む感染症やがん治療などの非感染系でみられる免疫制御の破綻の総称となっており,作用機序や病態は個々の疾患で異なると考えられる。
・COVID-19におけるサイトカインストーム
COVID-19では,感染患者の肺胞や血液中についての多くの解析がなされ,知見が蓄積している。サイトカインストームで共通している点は,IL-6,IL-2,TNF,IL-1β,IL-10,IFN-γなどのサイトカインや,IL-8/CXCL8,CCL2/MCP1,CXCL10/IP-10などのケモカインの過剰な分泌が観察され,疾患の重篤化に相関していることである7, 8, 16)。気道や肺胞での感染におけるこれらの炎症応答では,単球由来マクロファージや好中球などが動員され(第2回も参照),さらに炎症応答が亢進する(図3)。これらのサイトカイン分泌は,肺胞内細胞でのTLRやRLRによるウイルス感染検知による応答に加え,別の細胞内PRRであるNod様受容体(NLR)のNLRP3などが形成するインフラマソーム(炎症やアポトーシスに関与する細胞内の蛋白質複合体)の活性化を介しても誘導される17)。インフラマソームは,コロナウイルス感染による細胞内イオンバランスの撹乱などにより誘導されることが報告されている18)。活性化したインフラマソームは,カスパーゼ1の活性化を介したIL-1βやIL-18の分泌と共に,活性化ガスダーミンDによる細胞膜破壊を通じてプログラム細胞死のひとつであるパイロトーシス(pyroptosis)を誘導し,ATPや細胞ゲノムDNAなどのdanger-associated molecular pattern(DAMPs)の細胞外への放出をもたらし,炎症応答と細胞損傷をさらに増強すると考えらえる。その結果,肺のバリア機能障害と透過性が亢進し,急性呼吸窮迫症候群(ARDS)へ進行すると考えられる。
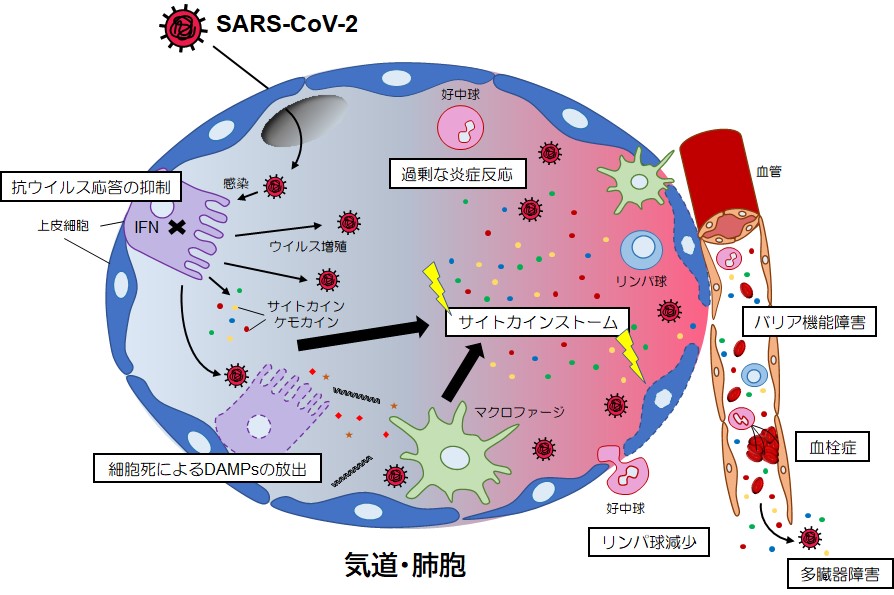
・CD4+T細胞,CD8+T細胞,NK細胞の減少
マクロファージや好中球の増加に対して,組織や血中のCD4+ならびにCD8+ T細胞やNK細胞の減少が報告されており,これらの細胞による適切なウイルス排除ができない状況に陥っていると考えらえる。これら免疫の暴走による血中サイトカインの亢進と免疫応答の破綻は,呼吸器だけでなく循環器,消化器,泌尿器,脳神経を含む多臓器疾患へ広がり,高い致死率や疾患の長期化の要因のひとつとなっている。また,各組織においてSARS-CoV-2の感染も確認されており,それぞれの組織でのウイルス感染とサイトカイン誘導が病態へ及ぼす影響については,より詳細な理解が必要であろう。
・免疫老化,慢性炎症
近年,免疫老化(inflamm-aging)という概念が提唱されており19),高齢の男性では慢性的にIL-6の発現が増強していることが示されている20)。また,既往症による慢性炎症は,気管や肺での炎症と組織損傷を通じてサイトカインストームを誘導する危険性が高いことが予想される。さらに,高齢者ではIFNの産生能が弱いことや,ACE2の発現が減弱している(炎症増強につながる)ことも知られており,これらの要因がCOVID-19の重症化に影響している可能性がある。
・デキサメタゾン,トシリズマブ
サイトカインストームの鎮静化を目指し,デキサメタゾンなどの抗炎症薬やトシリズマブ(抗IL-6受容体抗体)を含む複数の生物製剤が使用・検討されている。しかし,IFNの場合と同様に,炎症抑制はウイルスの増殖を許す可能性があり,病態と投与時期の関係などについて慎重な検討が必要であろう。
おわりに
COVID-19は100年前のスペイン風邪以来の世界的なパンデミックに拡大している。過去のコロナウイルスの知見や基礎・臨床研究の進歩を背景に,世界中で基礎・臨床研究が進み,驚くべきスピードでのワクチン開発と治療法の検討が進められているが,いまだ予断を許さない状況が続いている。一方で,今後も新たなコロナウイルスや鳥インフルエンザなどの新興・再興ウイルス感染症発生も十分に予想され,COVID-19の収束を目指した研究開発の継続と同時に,COVID-19の経験をどのように将来に活かすかが問われている。
文献
- 1) Sungnak, W, Huang N, Bécavin C, et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat Med 2020; 26: 681–687.[PubMed]
- 2) Park, A. & Iwasaki, A. Type I and Type III Interferons – Induction, Signaling, Evasion, and Application to Combat COVID-19. Cell Host Microbe 2020; 27: 870–878.[PubMed]
- 3) Onomoto, K, Onoguchi K, Yoneyama M. Regulation of RIG-I-like receptor-mediated signaling: interaction between host and viral factors. Cell Mol Immunol 2021;[PubMed]
- 4) Ziegler CGK, Allon SJ, Nyquist SK, et al. SARS-CoV-2 receptor ACE2 Is an Interferon- Stimulated Gene in Human Airway Epithelial Cells and Is Detected in Specific Cell Subsets across Tissues. Cell 2020; 181: 1–40.[PubMed]
- 5) Channappanavar R, Fehr AR, Vijay R, et al. Dysregulated Type I Interferon and Inflammatory Monocyte-Macrophage Responses Cause Lethal Pneumonia in SARS-CoV-Infected Mice. Cell Host and Microbe 2016; 19: 181–193.[PubMed]
- 6) Blanco-Melo D, Nilsson-Payant BE, Liu WC, et al. Imbalanced Host Response to SARS-CoV-2 Drives Development of COVID-19. Cell 2020; 181: 1–20.[PubMed]
- 7) Hadjadj J, Yatim N, Barnabei L, et al. Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science 2020; 369: 718–724.[PubMed]
- 8) Lucas C, Wong P, Klein J, et al. Longitudinal analyses reveal immunological misfiring in severe COVID-19. Nature 2020; 584: 463–469.[PubMed]
- 9) Bastard P, Rosen LB, Zhang Q et al. Autoantibodies against type I IFNs in patients with life-threatening COVID-19. Science 2020; 370: eabd4585.[PubMed]
- 10) Wang EY, Mao T, Klein J, et al. Diverse Functional Autoantibodies in Patients with COVID-19. medRxiv 2020 doi:10.1101/2020.12.10.20247205.[PubMed]
- 11) Zhang, Q, Bastard P, Liu Z, et al. Inborn errors of type I IFN immunity in patients with life-threatening COVID-19. Science 2020; 370: eabd4570.[PubMed]
- 12) Wang, N, Zhan Y, Zhu L, et al. Retrospective Multicenter Cohort Study Shows that Early Interferon Therapy is Associated with Favorable Clinical Responses in COVID-19 Patients. Cell Host Microbe 2020; 28: 455-464.e2.[PubMed]
- 13) Broggi, A, Ghosh S, Sposito B, et al. Type III interferons disrupt the lung epithelial barrier upon viral recognition. Science 2020; 369: 706–712.[PubMed]
- 14) Xia, H, Cao Z, Xie X et al. Evasion of type-I interferon by SARS-CoV-2. Cell Reports 2020; 33: 108234.[PubMed]
- 15) Ferrara JL. Cytokine dysregulation as a mechanism of graft versus host disease. Curr Opin Immunol 1993; 5: 794–799.[PubMed]
- 16) Liao M, Liu Y, Yuan J, et al. Single-cell landscape of bronchoalveolar immune cells in patients with COVID-19. Nat Med 2020; 26: 842–844.[PubMed]
- 17) Rodrigues TS, Keyla S G de Sá, Ishimoto AY, et al. Inflammasomes are activated in response to SARS-CoV-2 infection and are associated with COVID-19 severity in patients. J Exp Med 2020; 218: e20201707.[PubMed]
- 18) Chen IY, Moriyama M, Chang MF, et al. Severe Acute Respiratory Syndrome Coronavirus Viroporin 3a Activates the NLRP3 Inflammasome. Front Microbiol 2019; 10: 50.[PubMed]
- 19) Franceschi C, Garagnani P, Parini P, et al. A. Inflammaging: a new immune–metabolic viewpoint for age-related diseases. Nat Rev Endocrinol 2018; 14: 576–590.[PubMed]
- 20) Bonafè M, Prattichizzo F, Giuliani A, et al. Inflamm-aging: why older men are the most susceptible to SARS-CoV-2 complicated outcomes. Cytokine Growth F R 2020; 53: 33–37.[PubMed]